Микробиота оси «кишечник – мозг» во время болезни и в здоровом состоянии
Гамильтон, Канада
Аннотация
"Ось кишечник-мозг” представляет собой двунаправленную систему взаимодействия между ЦНС и желудочно-кишечным трактом (ЖКТ), которая состоит из тесно связанных нервных и гуморальных путей. В настоящее время имеются доказательства, полученные главным образом из исследований, проводимых на животных с использованием гнотобиологических моделей и путем раздражения микробиоты с помощью антибактериальных препаратов, того, что кишечные бактерии имеют большое значение в работе «оси кишечник-мозг», выступая здесь в роли модуляторов и посредников сигнальных путей.
Введение
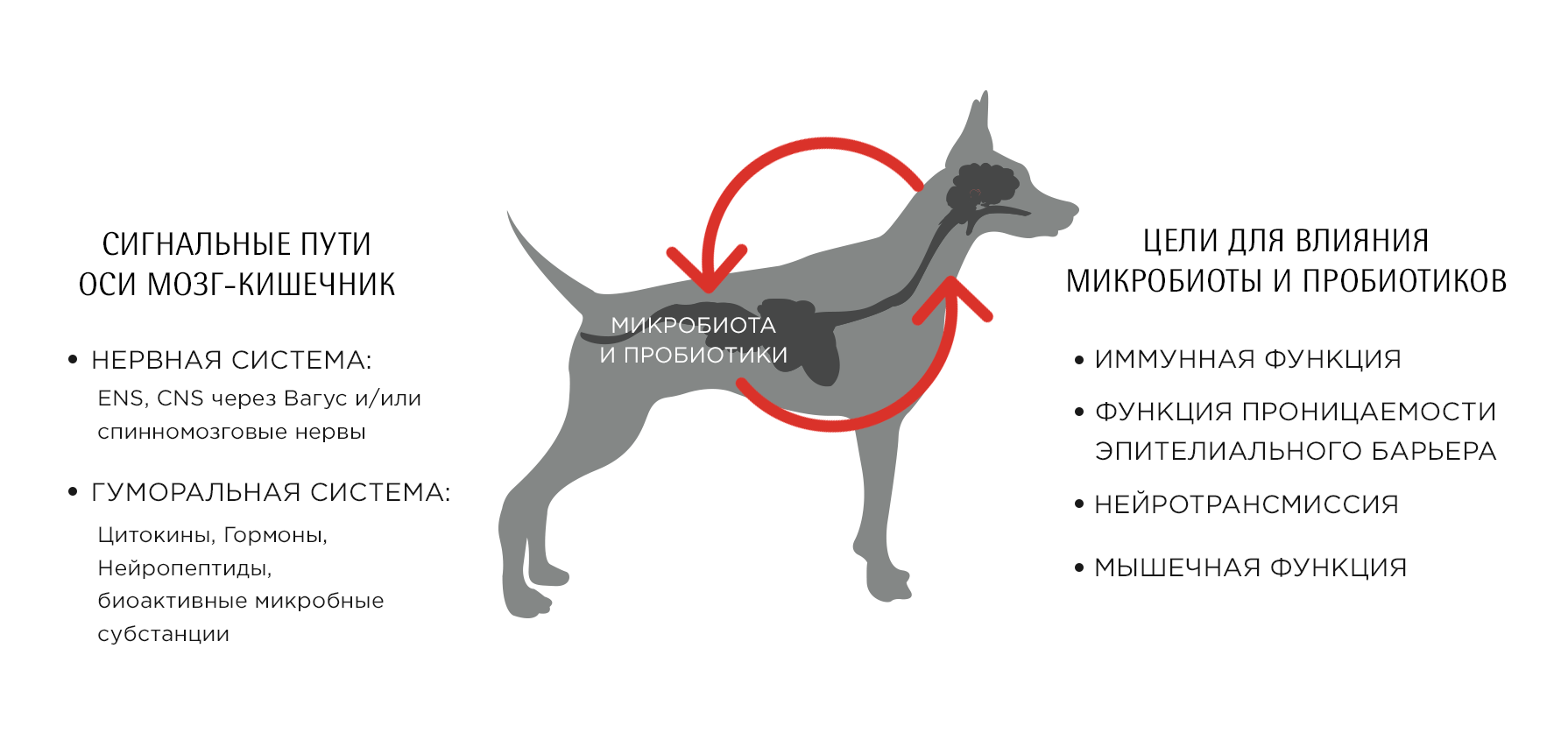
Клиницисты и исследователи уже давно признают наличие определенной связи между работой центральной нервной системы (ЦНС) и функционированием желудочно-кишечного тракта. "Ось кишечник-мозг” представляет собой двунаправленную систему взаимодействия между ЦНС и желудочно-кишечным трактом. Она состоит из нервных и гуморальных путей, включающих нервную систему кишечника, вагус, симпатические и спинномозговые нервы, а также гуморальные пути, в том числе цитокины, гормоны и нейропептиды, служащие сигнальными элементами. Недавние результаты исследований животных имеют большой интерес для изучения ключевой роли кишечных микробов во взаимодействии мозга с кишечником (Рисунок 1).
Рисунок 1: Ось кишечник-мозг. Пути сообщения и мишени для пробиотиков.
Кишечная микробиота включает в себя большое количество микробов разных видов. Она может считаться послеродовым приобретенным органом, выполняющим различные функции для своего хозяина, с которым она развивает двустороннее взаимодействие. Эти функции играют решающую роль в развитии врожденных и адаптивных иммунных реакций и влияют на различные физиологические системы на протяжении всей жизни хозяина, модулируя деятельность кишечника и кишечного барьера, усвоение питательных веществ, и распределение соматического и висцерального жира.